درس المواد والكهرباء (الذرات والأيونات) للسنة الثالثة إعدادي
كل شيء مادي في الكون، من حبات الرمل إلى أكبر الكواكب و أبعدها، يتألف من جسيمات دقيقة تدعى ذرات التي توجد في المواد الحية والغير حية فالبقرة مثلا عناصرها الرئيسية كربون (C) هيدروجين (H) أوكسجين (O) أزوت (N) كالسيوم (Ca) ، والأشجار ذراتها الرئيسية هي كربون (C) هيدروجين (H) أوكسجين (O)، والسيارة عناصرها الرئيسية هي الحديد (Fe) الألومنيوم (Al) الكربون (C) الكروم (Cr) النيكل (Ni).
جاءت كلمة الذرة من الأصل الإغريقي «atomos » التي تعني الجزء الذي لا يتجزء. والذرات من الصغر والدقة بحيث تستحيل رؤيتها بأقوى مجهر، ويمكن تصویرها فقط بواسطة مجهر المسح الإلكتروني الفائق القدرة جدا، فالدرهم الفلزي مثلا يحتوي على أكثر من عشرين ألف مليار ذرة.
ولقد شهد مفهوم الذرة تطورات كبيرة عبر التاريخ، فكان مفكرو اليونان منذ أكثر من ألفي سنة يعتقدون بأن الذرة تعني الجوهر الذي لا يتجزأ إلى ما هو أصغر. وفي عام 1804 أعلن الكيميائي الإنجليزي جون دالتون (Dalton) نظريته القائلة إن جميع الذرات في العنصر الواحد متطابقة تماما لكنها تختلف عن ذرات أي عنصر آخر (ذرة الهيدروجين هي أصغر وأخف ذرة وذرة الحديد هي من الحجم المتوسط، أما ذرة الرصاص من الذرات الكبيرة والثقيلة) .
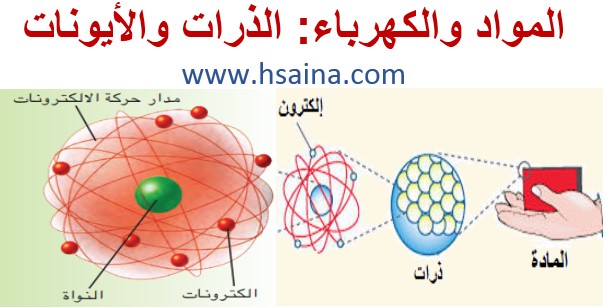
وأدت تجارب العالم البريطاني ج. ج. طومشون سنة 1897 إلى اكتشاف جسيمات دقيقة ، أخف 1836 مرة من أصغر ذرة معروفة، سميت الواحدة منها إلكترون. وقد اعتقد طومسون أن هذه الإلكترونات تتوزع على سطح الذرة.
في سنة 1911 حققت تجارب العالم إرنست رذرفورد ((Ernest Rutherford النيوزيلندي المولد أن الذرة تتكون من نواة مركزية عالية الكثافة تدور حولها الإلكترونات في شبه سحابة إلكترونية، وتبين أن النواة تشغل حيزا صغيرا جدا داخل الذرة، إلا أنها تتركز فيها غالبية کتلتها.بعد عامين فقط من اكتشاف رذرفورد اقترح الفيزيائي الدانماركي نیلز بور (Niels Bohr) أن الإلكترونات هي جسيمات مشحونة سلبا ومتناهية في الصغر تدور حول النواة المشحونة إيجابا في مدارات محددة دون غيرها كما الكواكب حول الشمس، وهذه المدارات تنتظم في طبقات. أما في عصرنا هذا فلقد أثبت الباحثون أن الذرة متكونة من نواة حاملة لشحنة كهربائية موجبة ومجموعة من الإلكترونات حاملة لشحنة سالبة.
تميل ذرات الفلزات أثناء التفاعل الكيميائي إلى فقدان إلكتروناتها الخارجية إلى ذرات عناصر أخرى وتتحول إلى أيون موجب يحمل عددا من الشحنات الموجبة مساويا لعدد الإلكترونات المعطاة. بينما تميل ذرات اللافلزات أثناء التفاعل الكيميائي إلى اكتساب إلكترونات من ذرات أخرىليكتمل مستواها الخارجي وتتحول إلى أيونات سالبة تحمل عددا من الشحنات السالبة مساويا لعدد الإلكترونات التي اكتسبها.


